鉄分を考える-土壌中の鉄が植物に与える影響
園芸用土について調べていると、
「赤玉土は鉄が多く含まれています。」だとか
「桐生砂は鉄分を多く含んでいます。」
という文言を見かけます。本記事では、土選びの際、
「植物は土壌中の鉄を吸収できるの?」
「鉄は多い方がいいの?」
「土壌中の鉄は植物にどんな影響を与えるの?」
などの疑問にチャレンジしようと思います。
土壌中の鉄の多くは水酸化鉄、酸化水酸化鉄として存在する
鉄は、一般に SiO2、Al2O3 についで土壌中に多く含まれているそうです。
土壌は、岩石が長い年月をかけて風化することで出来上がります。土壌中の鉄は、風化の過程で鉄を含む岩石(カンラン石、緑レン石、角閃石、輝石、黒雲母など)からイオンの状態で溶けだしたものです。

しかし、土壌中の鉄がイオンの状態で存在することは少なく、水や酸素と反応して水酸化鉄や酸化水酸化鉄として存在することが多いようです。
水酸化鉄や酸化水酸化鉄は総称して「遊離鉄」と呼ばれます。鉄分が多いと言われる赤玉土や桐生砂も、遊離鉄が多いと思われます。
※成分表でFe2O3と記載されることがありますが、これは鉄含有量をFe2O3の量に換算したものです。実際にFe2O3だけが含まれている訳ではありません。
遊離鉄について
遊離鉄は 5 〜 10 nm の粒状で*1、表面積が大きく、粘土鉱物と同様に、イオン交換が行われるようです。リン酸イオン、重金属イオン、有機物などと配位子交換によって強く吸着し保持する事も知られています。*2
遊離鉄ができるまで
鉄はイオンの状態で土壌中の水に溶けだします。水中では 6 つの水分子が配位結合して、八面体を形成しています。
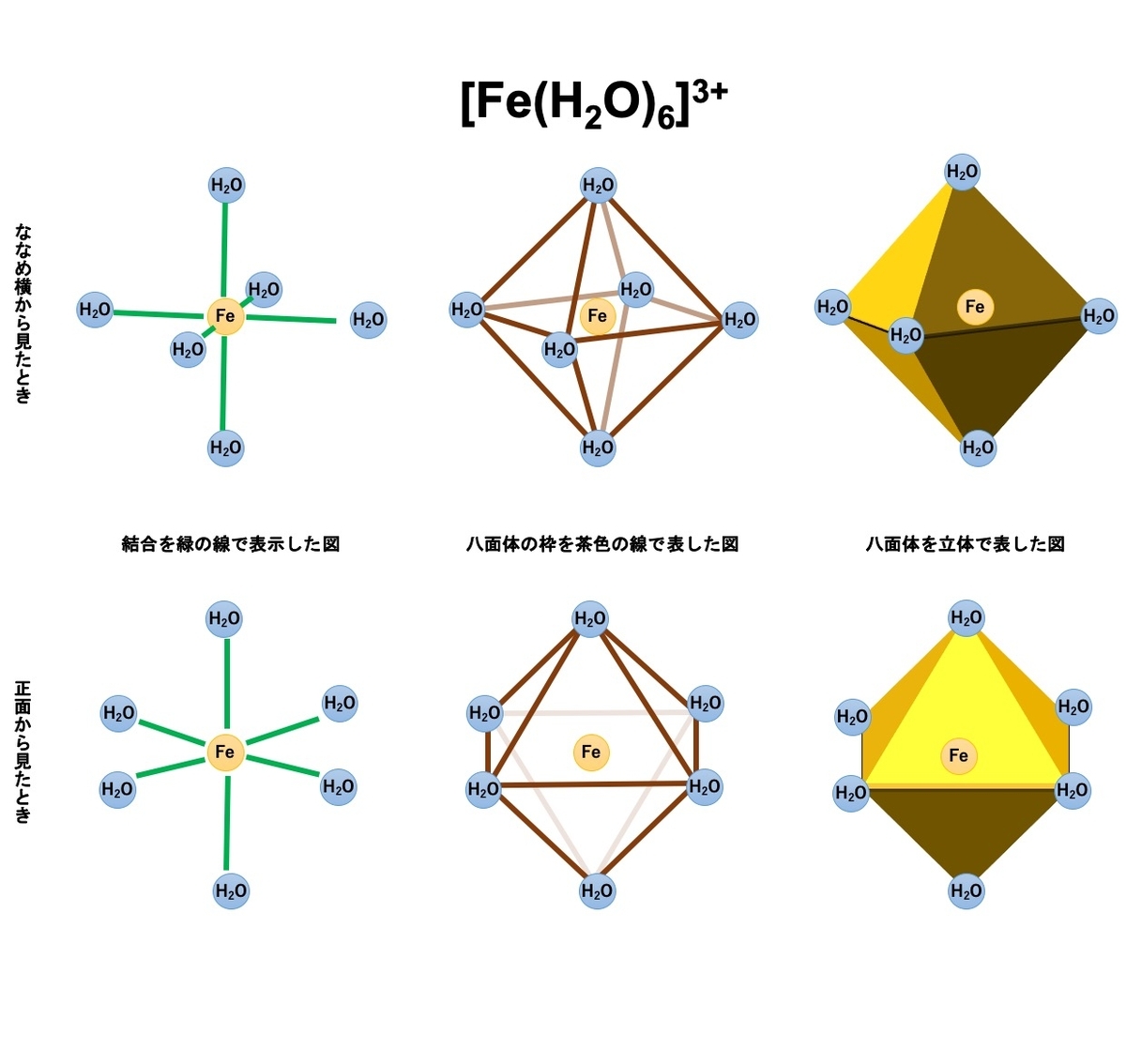
化学式を書く際、しばしば H2O を省略する時があります。そのため、Fe3+ と表記する場合があります。
溶液の pH が上がると加水分解により、H3O+が抜け、OH 基が配位する、いわゆる加水分解反応が起こります。この反応を「プロトリシス」といいます。

文献によっては [Fe(H2O)6]3+→ [Fe(H2O)5(OH)]2++ H+ と記述しているものあった。
pH が 2 に以上なると、[Fe(H2O)5(OH)]2+ が現れはじめ、pH が 4 を超えるあたりから、更にプロトリシスの進んだ [Fe(H2O)4(OH)2]+ が大半を占めるようになります。*3

Fe(H2O)3(OH)3⇔ [Fe(H2O)6-n(OH)n](3-n)+
pH が大きくなるほど、n に入る数字も大きくなる。
そして、それぞれの鉄イオンは脱水縮合により、 OH 基が橋渡し(架橋)する形でくっつきます。 この反応を「オレーション(Olation)」といいます。
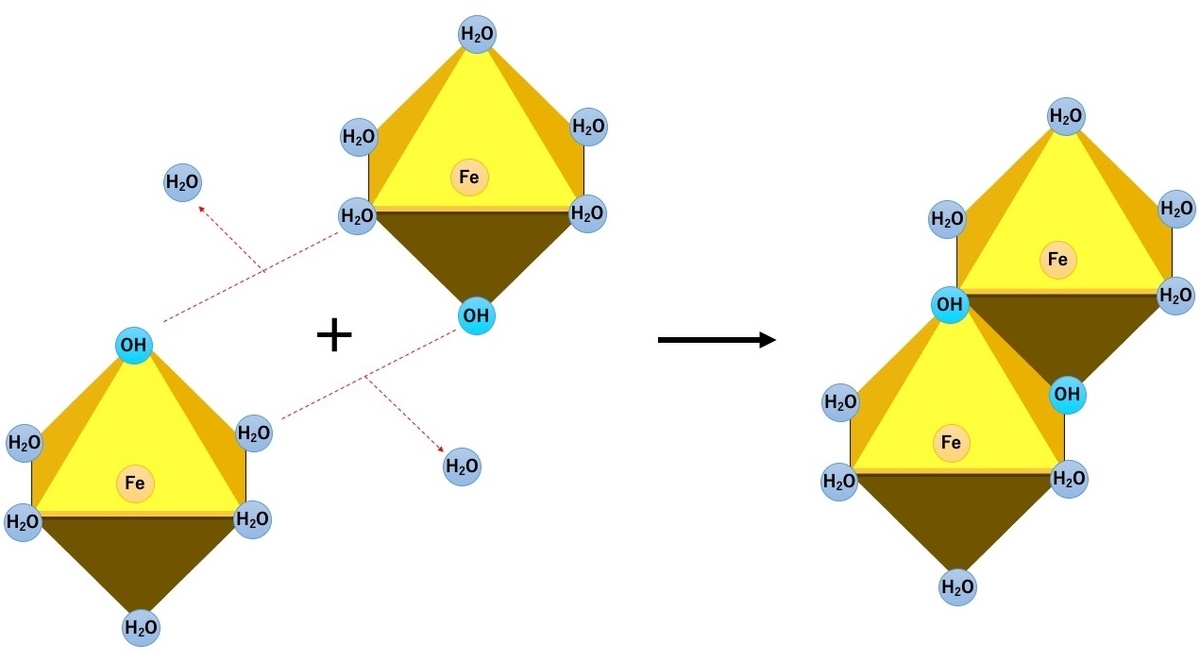
また、OH基同士がくっついて-O-で架橋する「 オキソレーション(Oxolation)」という縮合反応も起こります。

文献によっては「-OH- の場所にOが入れ換わる。」と書かれているものもあった。
これらの反応が繰り返され、いくつかの鉄イオンがくっついて「多核錯体イオン」と呼ばれる大きさになります。

多核錯体イオン同士がくっついてさらに大きくなると「胚」と呼ばれる大きさになり、もっともっと大きくなると、「核」と呼ばれる大きさになります。
「核」同士が集まって大きくなり、鉄鉱物(遊離鉄)になります。 土壌条件(温度、水分、pH、有機物含量、土壌溶液組成など)によって、鉄イオンの結晶構造は異なります。結晶構造が異なることで、様々な種類の鉄鉱物ができます。

参考:Influence of Anions and Cations on the Formation of Iron Oxide Nanoparticles in Aqueous Media (Hidekazu Tanaka 2020)
以上が遊離鉄の作られる過程です。鉄イオン同士がどんどん結合して、鉄鉱物(遊離鉄)となっていくわけですが、「鉄イオン」 〜「胚」までの過程は可逆的で、「胚」にまで大きくなったものがイオンに戻ることがあるようです。

参考:鉄酸化物の生成と構造
遊離鉄の種類
土壌中の酸化・水酸化鉄鉱物には、様々な種類があります。先ほど述べた通り、生成される遊離鉄の種類は土壌条件、気候によって変わります。また、含まれている遊離鉄の種類によって土壌の色が決まります。
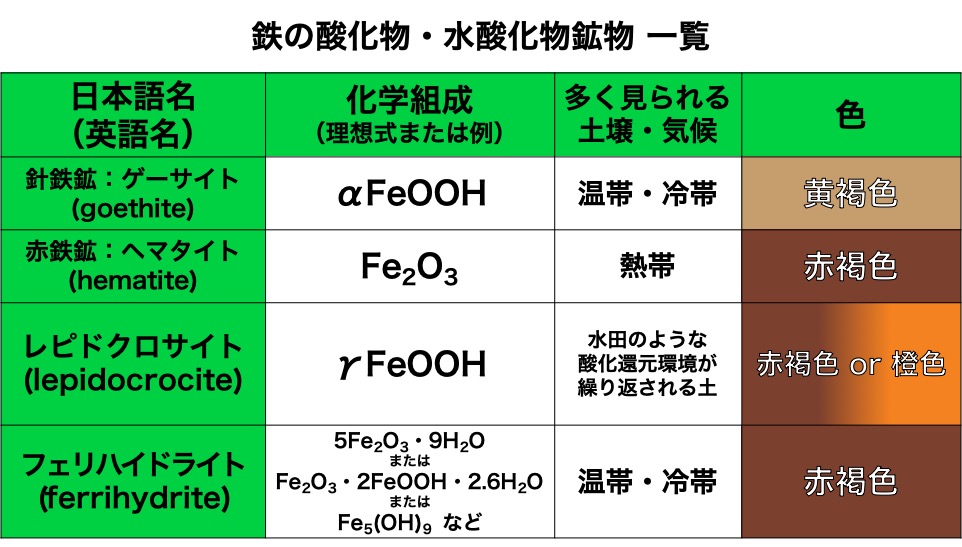
参考:和田光史・久馬一剛『土壌の事典』朝倉書店(1993)、和田信一郎の科学情報『二次鉱物の構造と性質』
これらの中で最も広く見られるのは、ゲーサイトで、次に見られるのがヘマタイトとフェリハイドライトだそうです。*4
日本は多くの地域で温帯に分類されているので、赤玉土や桐生砂に含まれる鉄も、多くは「ゲーサイト」として存在していると思われます。
Fe(OH)3という水酸化物は存在しない
書籍等でFe(OH)3という鉄水酸化物を目にすることがあります。様々な反応の過程で一時的に生じることこそあるかもしれませんが、Fe(OH)3 は、自然界にはほぼ存在していません。
除鉄・除マンガン処理|近畿地水株式会社|水替排水・水処理の専門工事会社 に記載されているグラフでは、Fe(OH)3 のモル濃度の線自体が書かれていません。
おそらく、Fe(OH)3 は OH 基を 3 つ持っているため、オレーションやオキソレーションが非常に起こりやすいのだと思います。
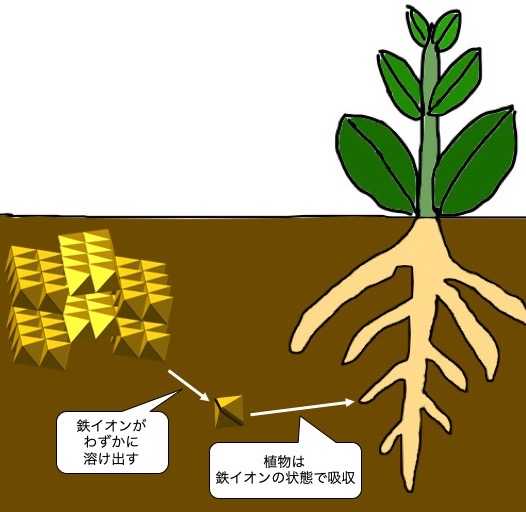
植物は遊離鉄を吸収できない
植物は鉄をイオンの状態で吸収します。土壌中の遊離鉄をそのままの形で吸収することはできません。植物は溶け出てくる鉄イオンを吸収しています。
水酸化鉄 - Wikipedia に水酸化鉄の溶解度積が掲載されています。
溶解度積 Ksp (= Ksol)とは
難溶性塩の飽和溶液中における陽イオンと陰イオン濃度の積。溶解度積は温度によって決まる定数であり、イオンの沈殿条件を求める上で重要な値。イオン濃度の積が Ksp の値を超えたときに沈殿が生じる。
出典:溶解度積 - Wikipedia
ちなみに各イオンの単位は[mol/L] で表すようです。
水酸化鉄 - Wikipedia に酸化水酸化鉄の溶解度積が掲載されています。
FeO(OH) + H2O ⇔ [Fe3+]aq + [OH-]3aq
Ksp = [Fe3+] [OH-]3 = 1 × 10-38
要するに、Fe イオンと OH イオンの濃度を掛け算して、 1 × 10-38 を超えるとが沈殿するという訳ですわ。
試しに、 pH = 7 のとき、どのくらいの Fe イオンがあると沈殿するのかを考えてみます。
Ksp = [Fe3+] [OH-]3 = 1 × 10-38
[Fe3+] = (1 × 10-38) ÷ ([OH-]3 の濃度)
pH = 7 のとき、OH- = 10-7 なので、
[Fe3+] = (1 × 10-38) ÷ ([10-7]3 ) = 1 × 10-27 mol/L
というわけで、pH = 7 のとき、1 × 10-27 mol/L より高い濃度になると、鉄は沈殿することになります。これってすごく小さい値ですよね。きっと植物はすごく少ない鉄イオンを見逃さず吸収しているのでしょう。
鉄分が多い用土のメリット&デメリット
ここまで、土壌中の鉄の正体や種類、植物がどのように鉄を吸収するかをまとめてきました。かなり遠回りになりましたが、鉄分が多い用土のメリットとデメリットを自分なりに書いてみます。
メリット:鉄を供給できる
遊離鉄は水に溶けにくいですが、全く溶けない訳ではありません。植物は鉄を欲する時、様々な戦略で鉄イオンを取り出します。土壌中に鉄があれば鉄欠乏の心配は減るでしょう。
デメリット:植物がリン酸を吸収しづらくなる
土壌中の鉄が多いと、リン酸と鉄が結合してしまい、植物が吸収しづらい形になってしまいます。赤玉土や桐生砂のリン酸吸収係数が高いのは、鉄分が多いのも一因かもしれません。
うーん、、、個人的にはデメリットのほうが大きいと感じましたが、皆様はいかがでしょうか。
まとめ
- 土壌中では、鉄分の多くは水酸化物・酸化水酸化物(遊離鉄)という形態を取っている
- 赤玉土や桐生砂の鉄分は「ゲーサイト」という形で存在している
- 植物は鉄を 遊離鉄の状態で吸収できない
- 鉄分の多い土のメリットは鉄を供給できることである
- 鉄分の多い土のデメリットは、植物がリン酸を吸収しづらくなることである
植物にとって、鉄は必須微量元素であると言われています。その鉄を多く含む土なんて、メリットしかないと思っていました。しかし、色々調べてみると、そうも言い切れないなと思い改めた次第です。
この記事が皆さんの土選びの一助になれば幸いです。
参考
【本】
【Web】